L’endocardite infettiva (EI) è una patologia che, nonostante i progressi compiuti in ambito diagnostico e terapeutico, è ancora oggi gravata da una mortalità elevata e da gravi complicanze; pertanto è stata evidenziata di recente la necessità di un approccio coordinato che coinvolga il medico di medicina generale, il cardiologo, il chirurgo, il microbiologo, l’infettivologo– vale a dire l’“Endocarditis Team”, e spesso altri specialisti: neurologi, neurochirurghi, specialisti in CHD e altri ancora.
Circa la metà dei pazienti con EI sono sottoposti ad intervento chirurgico nel corso della loro ospedalizzazione ed è quindi importante una tempestiva discussione collegiale con il team chirurgico, in tutti i pazienti con EI complicata (es. endocardite associata a scompenso cardiaco [SC], ascesso o complicanze emboliche o neurologiche).
L’EI può avere un andamento acuto o rapidamente progressivo, ma può anche presentarsi in forma subacuta o cronica con febbricola e sintomi aspecifici, ma la diagnosi di EI deve essere sospettata in ogni paziente con febbre e fenomeni embolici o con sepsi o febbre di origine sconosciuta in presenza di fattori di rischio cardiaci, quali precedente endocardite infettiva, cardiopatia valvolare, valvole cardiache protesiche, cateterismo venoso o arterioso, dispositivi elettrici impiantati per via e.v., cardiopatie congenite; oppure pazienti con fattori di rischio non cardiaci (uso di droghe e.v., immunosoppressione, procedure dentali).
La severità del quadro clinico può essere documentata da alcune indagini di laboratorio, quali il grado di leucocitosi/leucopenia, la PCR, la procalcitonina, la VES e i marcatori di danno d’organo terminale (elevati livelli di lattato e bilirubina, trombocitopenia, ipercreatininemia), parametri di laboratorio utilizzati anche nei sistemi a punteggio per la stratificazione del rischio operatorio nei pazienti con EI, EuroSCORE (European System for Cardiac Operative Risk Evaluation). Inoltre il pattern di attivazione dei mediatori infiammatori o dei complessi immuni, l’ipocomplementemia, elevati anticorpi anti-citoplasma dei neutrofili nella vasculite associata ad endocardite.
Le metodiche di imaging, soprattutto l’ecocardiografia, giocano un ruolo fondamentale sia nella diagnosi che nel trattamento dell’EI sia per la valutazione prognostica con EI, che per il follow-up in corso di terapia antibiotica.
L’ecocardiografia transesofagea (ETE) riveste un ruolo importate prima e durante il trattamento chirurgico (ecocardiografia intraoperatoria). Tuttavia, la valutazione dei pazienti affetti da EI deve comprendere altre tecniche di imaging come la TCMD, la RM, la tomografia ad emissione di positroni (PET). Infine la SPECT/TC che si basa sull’utilizzo di leucociti autologhi marcati (111In-ossima o 99Tc-esametilpropilenammina ossima).
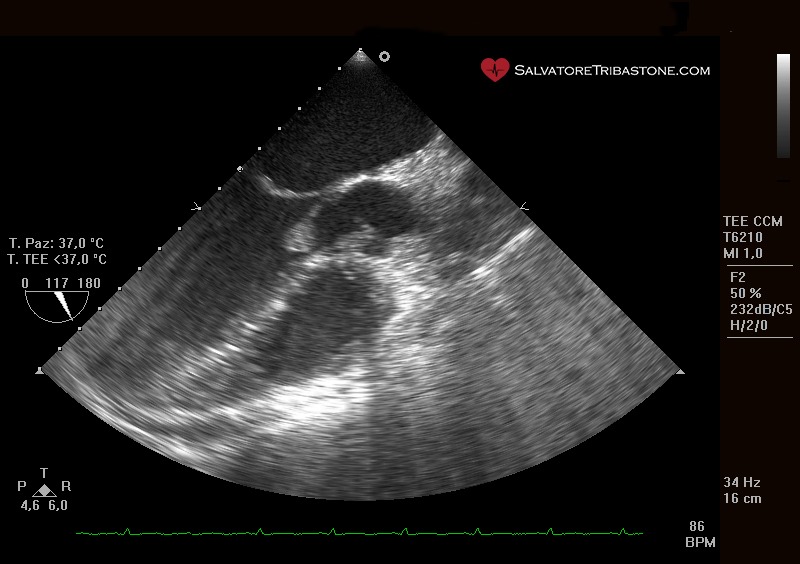
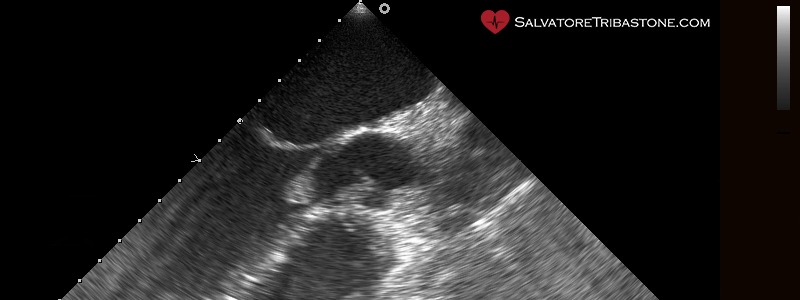
Vegetazione endocarditica su valvola nativa – Ecocardiografia Transesofagea
I tre reperti ecocardiografici considerati criteri maggiori per la diagnosi di EI sono i seguenti: la documentazione di vegetazioni, la presenza di ascessi o pseudoaneurismi e il riscontro di nuova deiscenza di una protesi valvolare.
La diagnosi microbiologica, con la positività delle emocolture, rimane il caposaldo della diagnosi di EI (almeno tre set, contenenti 10 ml di sangue prelevato a distanza di 30 min); l’emocoltura deve necessariamente essere ottenuta prima di somministrare la terapia antibiotica. La batteriemia ad andamento costante tipica dell’EI fa sì che non vi siano motivi per attendere il picco febbrile prima di effettuare il prelievo ematico e che tutte le emocolture risultino in teoria positive.
In caso di negatività di tutti i test microbiologici, deve essere presa in considerazione sistematicamente la diagnosi di endocardite non infettiva e devono essere eseguiti i test per gli anticorpi antinucleo, nonché per la ricerca degli anticorpi antifosfolipidi (anticorpi anticardiolipina [immunoglobolina-IgG], anticorpi anti-β2-glicoproteina 1.
In conclusione, l’ecocardiografia (ETT ed ETE), la positività delle emocolture e le caratteristiche cliniche rimangono il caposaldo della diagnosi di EI. La sensibilità dei criteri di Duke può essere aumentata utilizzando le nuove metodiche di imaging (RM, TC, PET/TC) che consentono di diagnosticare la presenza di complicanze emboliche a distanza e di interessamento cardiaco quando i reperti ETT/ETE sono negativi o dubbi. Per quanto utili, questi criteri non possono comunque essere considerati sostitutivi del giudizio clinico dell’Endocarditis Team.
La valutazione prognostica al momento del ricovero può essere eseguita avvalendosi dei semplici parametri clinici, microbiologici ed ecocardiografici e deve mirare a selezionare l’approccio iniziale più appropriato. I pazienti con emocolture persistentemente positive dopo 48-72h di antibioticoterapia hanno una prognosi peggiore. I pazienti con SC, complicanze perianulari e/o infezione da S. aureus mostrano il rischio più elevato di mortalità e devono necessariamente essere sottoposti ad intervento chirurgico.
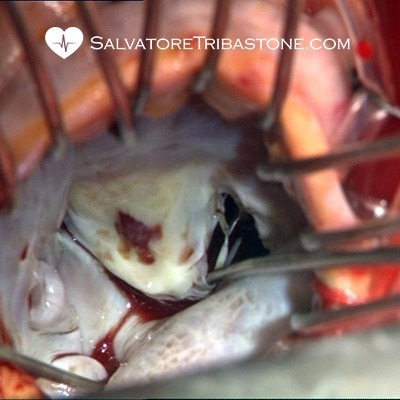
Immagine intraoperatoria di Endocardite su Valvola Mitrale
Terapia Antimicrobica:
Principi Generali: Il successo terapeutico si basa sull’eradicazione del microrganismo mediante farmaci antimicrobici. La chirurgia può essere di supporto nella rimozione del materiale infetto e nel drenaggio degli ascessi; i regimi battericidi si sono dimostrati più efficaci della terapia batteriostatica; l’associazione di aminoglicosidi con inibitori della parete cellulare (ad es. beta-lattamici e glicopeptidi) determina un effetto battericida sinergico che può consentire di ridurre la durata della terapia (ad es. streptococchi orali) e di eradicare gli organismi problematici (ad es. Enterococcus spp.).
I batteri a crescita lenta o dormienti mostrano una tolleranza verso la maggior parte degli antimicrobici (ad eccezione in una certa qual misura della rifampicina) e sono situati all’interno delle vegetazioni e dei biofilm (come nel caso della PVE), giustificando la necessità di una terapia prolungata (6 settimane) per la completa sterilizzazione delle valvole cardiache infette; il trattamento farmacologico della PVE deve essere di durata superiore (almeno 6 settimane) rispetto a quella prevista per l’endocardite su valvola nativa (NVE) (dalle 2 alle 6 settimane), ma è sostanzialmente simile, ad esclusione della PVE stafilococcica il cui regime terapeutico deve prevedere la rifampicina. Nei pazienti con NVE che necessitano di sostituzione valvolare con una protesi durante antibioticoterapia, il regime antibiotico postoperatorio deve essere quello raccomandato per la NVE e non per la PVE. Sia nella NVE che nella PVE, la durata del trattamento decorre dal primo giorno di terapia antibiotica efficace (emocoltura negativa nel caso di risultato iniziale positivo) e non dal giorno dell’intervento.
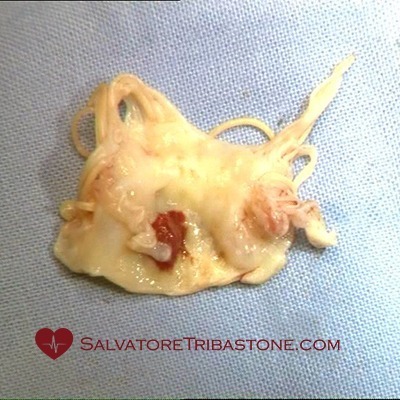
Valvola Mitrale escissa con lesioni endocarditiche
Elenchiamo di seguito i batteri patogeni più comuni riscontrati nell’EI rimandando alle linee guida (ESC 2023 ed aggiornamenti) le indicazioni terapeutiche:
- Streptococchi orali sensibili alla penicillina e gruppo Streptococcus gallolitycus
- Streptococchi orali e gruppo Streptococcus gallolyticus resistenti alla penicillina
- Streptococcus pneumoniae, streptococchi beta-emolitici (gruppi A, B, C e G)
- Granulicatella e Abiotrophia (precedentemente note come varianti nutrizionali degli streptococchi)
- Staphylococcus aureus e stafilococchi coagulasi-negativi. Il patogeno più frequentemente responsabile di EI acuta a carattere distruttivo è lo S. aureus, mentre i ceppi CoNS sono causa più comune di prolungate infezioni valvolari (fatta eccezione per S. lugdunensis e in alcuni casi per S. capitis).
- Stafilococchi meticillino- e vancomicino-resistenti I ceppi di S. aureus meticillino-resistenti (methicillin-resistant S. aureus, MRSA) producono una proteina legante la penicillina di tipo 2a (penicillin binding protein, PBP2a), caratterizzata da bassa affinità, da cui dipende la resistenza alla maggior parte dei beta-lattamici. Inoltre, sono generalmente resistenti ad una moltitudine di antibiotici al punto che la vancomicina e la daptomicina rimangono le uniche opzioni terapeutiche contro le infezioni severe.
- Enterococcus spp.: Enterococcus faecalis è la specie più frequentemente coinvolta nell’eziologia delle EI enterococciche (90% dei casi), seguito da Enterococcus faecium (5% dei casi). Questi batteri pongono due ordini di problemi: primo, sono altamente tolleranti all’effetto killing degli antibiotici e la loro eradicazione quindi comporta la somministrazione prolungata (fino a 6 settimane) di combinazioni ad azione battericida e sinergica di due inibitori della parete cellulare (ampicillina e ceftriaxone che agiscono in maniera sinergica nell’inibire le PBP complementari) o di un singolo inibitore della parete cellulare in associazione agli aminoglicosidi.
- Batteri Gram negativi
- Microrganismi del gruppo HACEK. I batteri Gram-negativi del gruppo HACEK sono dei microrganismi inusuali che necessitano di sistemi di valutazione
- Endocardite infettiva ad emocoltura negativa
- Miceti: I funghi si riscontrano prevalentemente nella PVE, nell’EI associata ad abuso di stupefacenti per via endovenosa (intravenous drug abuse, IVDA) e nei pazienti immunocompromessi. La maggior parte determinata da Candida e Aspergillus spp.
Terapia empirica
La terapia antibiotica per l’EI deve essere iniziata tempestivamente, dopo aver effettuato tre prelievi colturali a distanza di 30 min l’uno dall’altro. La scelta iniziale del trattamento empirico dipende da una serie di considerazioni: se il paziente abbia già ricevuto o meno cicli di terapia antibiotica; se l’infezione coinvolga una valvola nativa o una protesi (e, in quest’ultimo caso, quando è stato eseguito l’intervento chirurgico − PVE precoce vs tardiva); il luogo dell’infezione (EI acquisita in comunità, nosocomiale o associata alle cure sanitarie) e la conoscenza dell’epidemiologia locale, specie in riferimento ai livelli di antibiotico-resistenza. Regimi terapeutici consigliati per il trattamento empirico dei pazienti acuti: per la NVE e la PVE tardiva, il regime di terapia antibiotica deve essere adeguato a coprire gli stafilococchi, gli streptococchi e gli enterococchi, mentre quello per la PVE precoce o l’EI correlata alle cure sanitarie deve essere attivo contro gli stafilococchi meticillino-resistenti, gli enterococchi e, possibilmente, i patogeni Gram-negativi non appartenenti al gruppo HACEK. Una volta identificato il patogeno (generalmente nell’arco di 24-48h), la terapia antibiotica deve essere adattata al relativo profilo di sensibilità antimicrobica.
Principali complicanze dell’endocardite infettiva su valvola del cuore sinistro e loro gestione
Circa la metà dei pazienti con EI vengono sottoposti a trattamento chirurgico per l’insorgenza di complicanze. L’intervento chirurgico è indicato nei pazienti con Scompenso Cardiaco (SC) causato da insufficienza aortica o mitralica severa, fistole intracardiache od ostruzione valvolare secondaria alla formazione di vegetazioni, nonché nei pazienti con insufficienza aortica o mitralica acuta severa in assenza di documentazione clinica di SC ma con segni ecocardiografici di elevata pressione telediastolica ventricolare sinistra (chiusura precoce della valvola mitrale), elevata pressione atriale sinistra o ipertensione polmonare moderata-severa, sia in caso di NVE che di PVE. L’intervento chirurgico deve assolutamente essere eseguito in emergenza in quei pazienti che manifestano edema polmonare persistente o shock cardiogeno malgrado terapia medica.
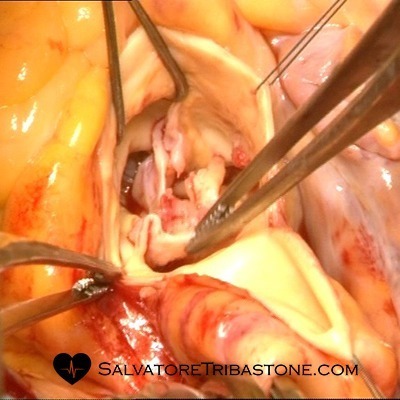
Immagine intraoperatoria di Endocardite su Valvola Aortica
Indicazioni alla Chirurgia e Timing Chirurgico In presenza di Infezione non controllata nell’endocardite
Infezione persistente: In alcuni casi di EI, la sola terapia antibiotica non è in grado di eradicare l’infezione. La chirurgia è indicata qualora, nonostante appropriato regime antibiotico, persistano febbre ed emocolture positive per diversi giorni (>7) o sepsi persistente e dopo aver escluso la presenza di ascessi extracardiaci (splenici, spinali, cerebrali o renali) ed eventuali altre cause della febbre.
Segni di infezione localmente non controllata: Un aumento delle dimensioni delle vegetazioni, nonché la formazione di ascessi, falsi aneurismi e fistole rappresentano i segni di infezione localmente non controllata, generalmente accompagnata da febbre persistente e per la quale è raccomandato l’intervento chirurgico nel più breve tempo possibile. In sintesi, le infezioni non controllate sono per lo più correlate all’estensione perivalvolare e a microrganismi “difficili da trattare”. Nei pazienti con EI il riscontro di infezione localmente non controllata costituisce indicazione al trattamento chirurgico precoce.
Gli eventi embolici sono molto frequenti, complicando il 20-50% dei casi di EI, con percentuali che scendono al 6-21% una volta iniziata la terapia antibiotica. Il cervello e la milza sono i siti più frequenti di embolia pe endocardite infettiva sinistra, mentre l’embolia polmonare è frequente nell’endocardite del lato destro e del PM. Il rischio di complicanze emboliche è massimo durante le prime 2 settimane di antibioticoterapia ed è inequivocabilmente correlato alle dimensioni e alla mobilità delle vegetazioni.
Altre complicanze:
Complicanze Neurologiche
Aneurismi Infettivi
Complicanze Spleniche
Miocardite o Pericardite
Ritmo Cardiaco e Disturbi della Conduzione
Manifestazioni Muscolo Scheletriche
Insufficienza Renale Acuta
© Pietro Di Gregorio per salvatoretribastone.com
© RIPRODUZIONE RISERVATA